毒殺藥物束 (cytotoxic drug bundles) 是由一個多臂鏈接體攜帶多個毒性藥物分子所組成。
在藥物束中的鏈接臂可以視需求設計,使之包含一個切位 (cleavable site),這類型切位對於標的組織微環境或內體/溶酶體中的蛋白酶很敏感,使得滿載鏈接體裡的小分子藥物在抵達標的組織或細胞時,可被切下而釋出。
我們使用的小分子藥物種類很廣,涵蓋不同功能,其中包括可毒殺細胞的藥物,如微管抑制劑 (microtubule inhibitors),常用的有 monomethyl auristatin E (MMAE) 和 monomethyl auristatin F (MMAF) ;拓璞異構酵素抑制劑 (topoisomerase I inhibitors),常見如 Deruxtecan (Dxd) 和 Exatecan (EXT);以及免疫調節藥物 (immunomodulatory drugs, IMiDs),如來那度安 (lenalidomide, Lena) 等都適用於製備毒殺藥物束。
另一方面,耦合臂 (coupling arm) 連接可進行點擊化學反應 (click reaction) 的反應基團,如 dibenzocyclooctyne (DBCO), bicyclononyne (BCN), trans-cyclooctene (TCO) 或是馬來酰亞胺基團 (maleimide group),將藥物束連結於抗體分子。
而藥物束的溶解度可透過鏈核心、耦合臂、鏈接臂的組成來調整,例如於耦合臂末端的馬來酰亞胺 (maleimide) 基團附近設計酸性胺基酸,其負電荷簇使馬來酰亞胺成為更強的親電體,得到更佳的溶解度。
以下為毒殺藥物束的多元化設計平台:
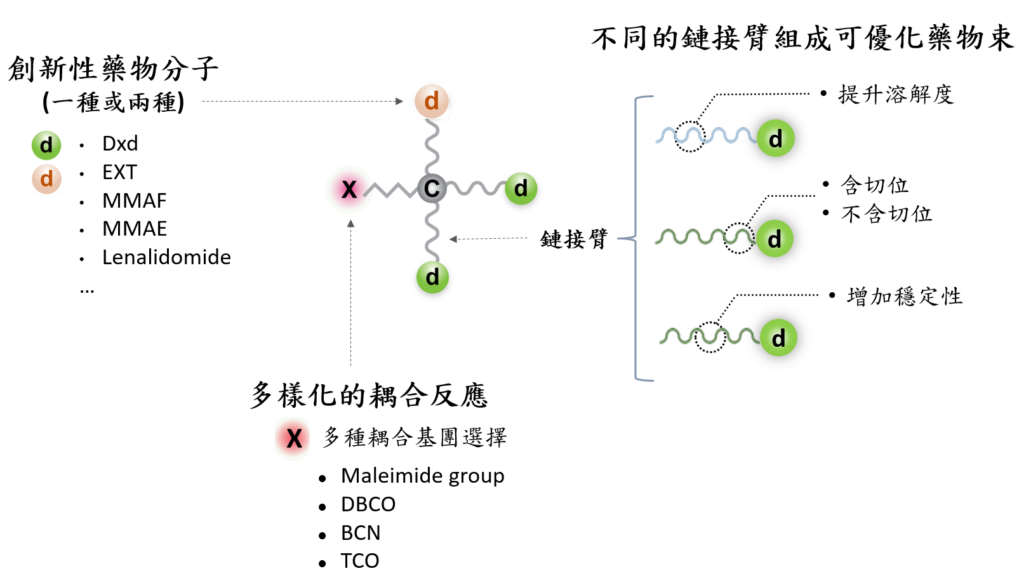
我們的毒殺藥物束設計多樣化,能夠快速組裝並生產各種藥物束,以滿足不同的偶聯需求,實現ADC藥物的客製化設計與規模化生產。
除了能夠生產攜帶一種毒殺藥物的藥物束外,我們的平台還能快速且高效地生產雙藥毒殺藥物束,成功突破ADC藥物攜帶兩種不同藥物的技術門檻,為抗藥性腫瘤及異質性腫瘤的治療帶來新希望。
我們致力於推動此藥物束平台的應用,無論是希望設計何種藥物組合模式,我們都歡迎業界夥伴洽談合作,並透過不同商業模式進行授權。
應用於建構兩種ADC平台
當攜帶單藥或雙藥的毒性藥物束與抗體結合時,即可形成抗體藥物複合體 (antibody-drug conjugate, ADC) 。
基於不同抗體結構,我們進一步開發了兩種ADC平台,可廣泛應用於生成高藥物-抗體比 (drug to antibody ratio, DAR)、高純度且均質化的新型ADC分子。
1. scFv-based ADC
在我們優化的構建中,抗體的抗原結合區域 (fragment-antigen binding, Fab) 被重新建置為單鏈可變片段 (single-chain variable fragment, scFv)。因此,scFv-based ADC 是由兩條經雙硫鍵共價連接的延長重鏈抗體部位,與毒殺藥物束結合而成 (詳細說明請參考諦醫生技網頁 https://www.temeds.com/scfv-based ADC )。
2. CHO-TEM ADC
諦醫生技與醣基生醫建立策略合作關係,運用雙方的互補技術,共同開發了CHO-TEM ADC 平台。我們採用醣基生醫獨特的「醣分子修飾」技術,修飾包含整個 IgG 抗體上的醣分子側鏈,與毒殺藥物束結合後,建構 CHO-TEM ADC 新藥分子 (詳細說明請參考諦醫生技網頁 https://www.temeds.com/CHO-TEM ADC) 。
兩項ADC平台設計所產生的ADC新藥分子成功展現五大優勢:
- 產生均質化ADC:以定點偶聯技術將藥物束接在抗體上,可產出高純度且均質化ADC藥物。
- 簡單有效率的生產方式:不需要使用非天然胺基酸或酵素催化。
- 高藥物抗體比 (DAR): 可產生高DAR的ADC藥物,進一步提升療效。
- 溶解度與穩定性良好: 透過多臂鏈接體的精巧設計,使ADC藥物具備良好的溶解度與穩定性,可提升藥物動力學表現、降低毒性風險。
- 產生可攜帶兩種藥物的ADC:成功克服雙重有效負載 (dual-payload) 的技術挑戰,使ADC藥物攜帶兩種不同藥物,為抗藥性腫瘤及異質性腫瘤的治療提供新契機。
